癌症幾乎成為現代人的文明病之一,血癌更被排名在癌症死亡中的第十位,如何知己知彼打敗病魔,成為相當重要的研究課題。由臺大醫院血液腫瘤科田蕙芬主任、臺灣大學生醫電資所莊曜宇所長組成之跨領域研究團隊,分析約三百名血癌病患之基因巨量資料,發現了可成功預測血癌治療後存活率的基因標記,未來可望對確診病患進行篩檢,提供臨床醫師選擇治療方式之參考,提高個別病患的治療效果。
針對急性骨髓性白血病的2項分析成果
急性骨髓性白血病是臺灣血癌中年發生率最高的一種類型,臺灣每年約有八百名新增病例,主要症狀為骨髓中白血球過度增生及分化失常,導致正常造血功能受到影響,病人會出現貧血、發燒、容易出血等現象。血癌發生的真正原因尚不清楚,最近的研究顯示,這種病人的白血病細胞中有許多基因的突變,與血癌的發生可能有重要關聯。
在這項跨領域研究中,研究團隊利用高通量生物晶片技術,分析臺大醫院約三百名血癌病患之基因表現圖譜,取得全基因表現之巨量資料,並使用生物資訊之分析方法,在數百個微小核糖核酸與幾萬個基因中,發現了在血癌中相當重要的三個微小核糖核酸(miR-9-5p、miR-155-5p與miR-203),以及另外十一個基因的表現可以預測病人的預後。
臺大研究團隊將這些微小核糖核酸及基因分別建構了兩套預測分數系統,未來病患在確診時,只需要測量這些微小核糖核酸及基因的表現情形並計算分數,即可快速的預測病患未來對治療的反應。
如下圖所示,分數越高的病患治療後風險較高;這個預測分數每增加一分,病患的死亡風險就會增加為2.1倍,醫師即可依此資訊,對高風險病患進行強度較高之治療方式(如骨髓移植),以提高病患治癒率。
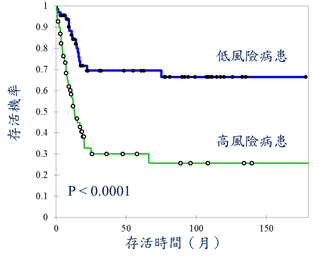
利用三個微小核糖核酸的表現成功預測血癌病患之預後狀態
在這項研究的第二部分,研究團隊鎖定約四分之一帶有NPM1基因突變的血癌患者。此研究首度提出,該基因突變具有破壞血癌細胞中正常的「基因調控網路」之能力,更可能因此影響病患的預後,研究團隊並利用分子生物實驗與國際的血癌病患資料驗證了這個發現。這些成果不僅有助於了解血癌細胞內錯綜複雜的突變基因與基因網路,更提供未來抗血癌研究及開發新治療之可能標的。
個人化治療提高治癒率
本研究的發現為未來血癌治療提供突破性的進展,更呼應了美國總統歐巴馬在今年所提出的「精準醫學計畫(Precision Medicine Initiative)」,未來透過偵測這些分子標記,醫師得以了解每個患者的腫瘤細胞特性,安排個人化的治療方式,提高治癒率。
研究成果發表於國際頂級期刊
上述研究成果,已陸續發表於國際腫瘤類期刊中排名前5%之白血病期刊(Leukemia)與前10%之腫瘤標靶(Oncotarget)等頂尖期刊。
精準醫療降低醫療時間與成本
本次研究的意義在於,急性骨髓性白血病確診後,醫師開始治療計劃前,先利用基因篩檢,找出病人的miR-9-5p、miR-155-5p與miR-203這三個微小核糖核酸與十一個的基因型態,再決定最適合病人的治療方式,達成「精準醫學」個人化治療的目標,同時有效地減低醫療資源的支出(如下圖所示)。
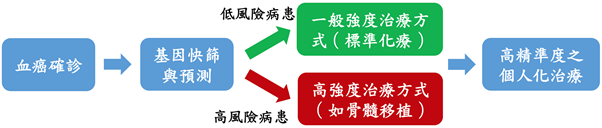
本研究成果未來在精準醫學之應用
詳細全文請詳:http://www.ntu.edu.tw/spotlight/2015/667_20151111.html
