|
認識CPAM:罕見的先天性肺部發育異常
先天性肺部呼吸道畸形(congenital pulmonary airway malformation, CPAM)是一種先天性的肺部發育異常,病灶常呈現異常囊泡狀構造,因此過去也被稱為先天性囊腫性腺瘤樣畸形(congenital cystic adenomatoid malformation, CCAM)。傳統估計其發生率每10,000至30,000個活產嬰兒中有1例,但近年可能由於產前超音波診斷技術的普及與進步,較新的報告顯示發生率明顯增加,目前估計約為每2,000~8,000個活產嬰兒中有1例。
CPAM的臨床表現變異大,多數新生兒出生時無明顯症狀,但若病灶較大,可能壓迫縱膈與肺臟,造成胎兒水腫或出生後出現呼吸窘迫,需緊急手術處理(約10%)。目前尚無理想的產前工具能準確預測出生後症狀的嚴重程度,產前最常使用的評估方式為超音波測量CPAM體積與胎兒頭圍的比值(CPAM volume ratio, CVR),CVR > 1.6 cm2屬於最嚴重的病患群,胎兒水腫風險約80%;而CVR小於0.4者,出生後呼吸窘迫的風險通常低於10%。另一項產前輔助評估工具為胎兒核磁共振造影(fetal MRI),可提供更完整的解剖資訊,但是若病灶較小,MRI的影像解析度可能不如超音波,因此通常僅於超音波病灶影像不明、或病灶較大須規劃產後早期手術時使用。
出生後,評估CPAM的標準診斷工具為胸部電腦斷層血管攝影術(computed tomography angiography, CTA),因其能清楚顯示肺部內部構造病變以及血管分布,幫助外科醫師了解病灶大小、位置、影響肺葉、異常血管分布,以進行完整術前計畫評估。胸部X光雖然較便利,但僅能偵測明顯病灶,約有半數的CPAM病灶無法在出生的胸部X光上辨識,也無法預測症狀嚴重程度或是輔助手術計畫,故多用於初步篩檢與術後追蹤。
出生後無症狀的CPAM應該手術或觀察?
有症狀或有異常血管供應的CPAM病童通常需要接受手術切除,此類症狀可能包括呼吸窘迫、嚴重縱膈腔位移導致心肺壓迫、肺炎、氣胸、餵食困難、高心輸出心衰竭(若有大的由體循環而來異常供應血管)等。但對於大部分無症狀者是否須早期手術,至今仍有爭議性。支持早期預防性手術的觀點主要為:預防感染氣胸等症狀、促進健康肺葉代償性生長(肺部可持續發育至8歲)、避免惡性轉變風險(雖罕見,約1-4%)、及單靠影像上診斷的不確定性等。而支持保守觀察的論點則認為部分病灶可能自行縮小或消失、手術麻醉具潛在風險、且惡性轉變風險極低。這些爭議仍有待對CPAM疾病的自然病程與分子機轉更深入的了解才能釐清。
然而,隨著微創胸腔鏡手術的普及以及麻醉進步,手術風險及侵入性已逐漸降低;部分接受觀察的病患仍可能於追蹤期間發生感染或症狀而需手術(終生確切發生率不明,部分研究估計約為5-10%,主要嚴重感染年紀發生於2歲後);一旦發生感染,孩子可能併發較嚴重肺炎,需要住院接受抗生素治療,治療較困難,更麻煩的是,感染一旦發生往往傾向反覆發作,且需待感染緩解後再行手術,風險與複雜度也相對提高(圖1);此外,長期依賴CT追蹤亦增加輻射暴露。因此,目前本院與國際上的大部分共識仍傾向建議無症狀的CPAM接受早期手術切除,尤其是具有較高風險者(表1)。惟醫師仍需同時考量病患病灶特徵、其他合併症、而保留個體化的處理策略。另外,研究發現部分CPAM病例中,DICER1基因的突變與惡性腫瘤或癌前病變相關,因此若欲選擇追蹤者,可考慮篩檢是否有此基因突變,以了解惡性變化的風險。儘管每個孩子情況不同,治療決策需要綜合考量,但家長應了解手術與觀察性治療對孩童的各自風險與益處,以便與醫療團隊討論出最佳方案。
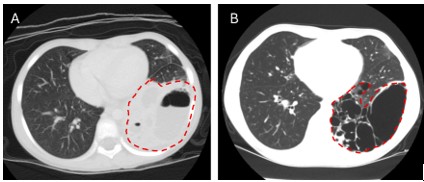 |
| 圖1. 一名先前未診斷的7歲女童,首次發生症狀即以反覆嚴重肺炎表現(A),待肺炎稍緩解可辨識其位於左下肺葉的多發性囊狀CPAM病灶(B)。 |
 |
嬰幼兒童CPAM手術的進展:微創技術、個人化手術計畫、與更精準的病灶定位
近20年來,胸腔鏡微創手術已逐漸取代傳統開胸手術,不僅疼痛較少、縮短住院天數、亦降低長期胸廓變形風險等,雖然嬰幼兒手術挑戰較大(因體型小、組織脆弱),但在有經驗的醫療團隊中,已成為常規選擇(圖2)。
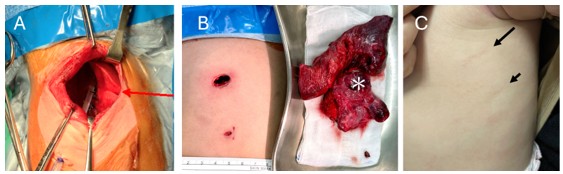 |
| 圖2. 胸腔鏡微創手術的進展,使得嬰幼兒CPAM手術的侵入性大幅降低
(A)傳統開胸手術的傷口 (B) 6個月大嬰兒接受雙孔胸腔鏡微創手術,兩個小傷口(1.5公分,0.5公分)可切除整個病灶肺葉(*)(C)胸腔鏡手術後半年追蹤外觀良好,疤痕幾乎不可見(箭號)
|
醫學影像的進展,使得外科醫師可以為病人制訂更個人化的手術計畫,例如針對病灶較複雜的病患,可在術前進行電腦斷層3D影像重組,更精確呈現病灶與血管、支氣管位置關係(圖3),協助外科醫師判斷是否適合進行亞肺葉切除手術(sublobar resection),例如肺節切除(segmentectomy)或楔形切除(wedge resection),亞肺葉切除可保留更多健康肺組織,尤其對病灶較小﹑邊界清楚,或影響多個肺葉者更為合適。為提高手術精準度,術中也可使用導引技術,協助辨識病灶邊界與正常肺組織的分界,達到精準切除(圖4)。
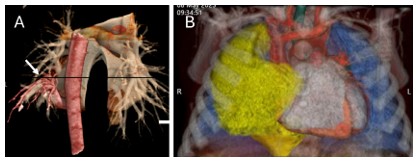 |
| 圖3.術前電腦斷層3D重組影像可幫助(A)辨識異常血管(箭號),確認診斷;以及(B)更精準呈現病灶(黃)與正常肺組織(藍)、血管、支氣管之相對位置。
|
此外,國外也開始有早期研究,運用3D虛擬實境(virtual reality, VR)於CPAM病灶位置評估,未來有機會擴及輔助手術計畫,有望提供更精準的兒童肺部手術術前與術中評估。
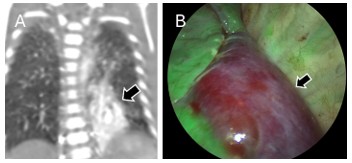 |
| 圖4. (A)術前電腦斷層評估較小、較侷限的病灶,可於術中佐以(B)靛氰綠(ICG)螢光導引技術,幫助外科醫師辨識病灶(箭頭)與正常肺組織(螢光綠)的分界,達到精準的亞肺葉切除。
|
術後照護的進步:ERAS在兒童肺部手術中的應用
加速術後康復怡樂適療程(ERAS, Enhanced Recovery After Surgery)為近年興起的圍手術期整合照護理念,強調以病患及家庭為中心,透過一系列術前、術中、術後措施,減少手術壓力與衝擊、縮短恢復時間。事實上,CPAM手術的術後恢復成效,除了仰賴外科醫師的技術,也需仰賴一整個專業團隊的共同努力。雖然ERAS在成人手術中已廣泛推行,但在小兒外科領域則是近幾年才開始逐步受到重視。臺大醫院今年開始導入適用於嬰幼兒童肺部手術(例如CPAM肺葉切除)的ERAS照護流程,結合小兒外科醫師、兒童麻醉醫師、兒童胸腔重症照護醫師、物理治療師、護理師等團隊專家小組,內容包括以下幾個重點:
- 術前準備與教育:術前進行完整評估與衛教,讓家長了解手術流程、風險與照護重點。針對病童本身,則視情況進行感染控制、改善營養與術前肺部復健等預備處理,讓身體狀況達到最佳手術條件。
- 多模式疼痛控制:有效的疼痛控制是ERAS的核心之一,也是術後恢復的重要指標。團隊會採取多模式鎮痛策略,從術前先制鎮痛開始、麻醉期間進行局部與區域神經阻斷,術後搭配對年齡與症狀合適的非鴉片類止痛藥物,減少術後管路,並主動、定時評估孩子的疼痛程度。
- 術中照護流程化:麻醉醫師精準調控麻醉深度、輸液管理以及單肺呼吸通氣等,外科醫師的技術優化以減少手術侵入性。
- 術後照護:積極移除不必要的管路(如氣管內管、鼻胃管、尿管、胸腔引流管等),並視情況儘早恢復進食與活動。早期活動有助於促進肺部擴張和痰液排出,並促進腸胃功能恢復。依照風險因子給予術後噁心嘔吐預防用藥等。
國外研究顯示,導入ERAS流程可顯著提升病患的恢復速度,縮短住院天數、減少併發症發生,並降低止痛藥(尤其是鴉片類藥物)的使用量、提升家長滿意度。本院也預期,透過ERAS的導入,能讓接受手術的CPAM的兒童更快、更舒適地康復,同時減輕家庭在治療過程中的心理壓力與負擔。
CPAM術後追蹤與長期預後:家長關心的三大重點
CPAM的手術雖大部分屬根治性處置,但術後的長期追蹤仍然重要。以下三個面向是目前研究較多、家長最關心的部分:
- 肺功能的影響:多數研究顯示,在兒童時期接受CPAM切除術的患者,其長期肺功能通常接近正常。病灶切除後,兒童剩餘的肺組織具有良好的代償性生長潛力,尤其早期手術可能更有利於肺部代償性生長。另外,胸腔鏡手術因其微創特性,對胸壁肌肉的影響較小,與傳統開胸手術相比,對肺功能保留更有優勢。而亞肺葉切除的病患因保留更多健康肺組織,理論上肺功能維持應較肺葉切除者更佳,但目前仍需更多長期數據佐證其優勢。
- 術後併發症與生活品質:若病灶完整切除,長期症狀(例如反覆感染、呼吸困難等)的發生率極低。研究顯示,大多數接受手術治療的CPAM病童,其日常生活功能與健康同齡人無顯著差異。傳統開胸手術後,可能會造成胸廓發育不對稱、肌肉疤痕等外觀問題,而微創手術大幅降低這些風險。
- 惡性轉變風險:惡性轉變的風險是支持早期手術的考量之一。雖然實際發生率極低,但確實有文獻報導部分病灶中發現與腫瘤前病變相關的組織,尤其在特定亞型(如Type 4 CPAM)中與罕見的胸膜肺母細胞瘤有關。一般認為完整手術切除可以消除惡性轉變風險,目前沒有證據顯示術後在原手術區域會再次出現與CPAM相關的惡性病變。針對選擇觀察者,若具有DICER1基因突變者,其轉變為腫瘤的潛在風險亦較高,應接受遺傳諮詢,與外科醫師共同規劃追蹤策略。
結語:給家長的話
CPAM雖然是一種令家長憂心的罕見疾病,但過去20年,相關的治療與照護持續進展,從產前篩檢、術前評估的精準化、手術技術的演進,到圍手術期照護模式的導入,治療效果和安全性持續提高。對於家長而言,了解這些最新資訊有助於與醫師共同制定最佳治療計畫。相信在醫療人員與家長的共同努力下,絕大多數患有CPAM的孩子都能夠健康快樂地成長,迎向美好的未來。
參考文獻
- Xu W, Gao Y, Li W, et al. A national descriptive epidemiologic analysis on congenital pulmonary airway malformation in China, 2010–2019. Pediatr Pulmonol. 2022;57(3):674-681.
- Lau CT, Kan A, Shek N, Tam P, Wong KKY. Is congenital pulmonary airway malformation really a rare disease? Result of a prospective registry with universal antenatal screening program. Pediatr Surg Int. 2017;33(1):105-108.
- Lima JS, Camargos PAM, Aguiar RALP, Campos AS, Aguiar MJB. Pre and perinatal aspects of congenital cystic adenomatoid malformation of the lung. J Matern-Fetal Neonatal Med. 2014;27(3):228-232.
- Pederiva F, Rothenberg SS, Hall N, et al. Congenital lung malformations. Nat Rev Dis Prim. 2023;9(1):60.
- Zhu T, Li Y, Zhang J, et al. Precise Thoracoscopic Pneumonectomy Using Fluorescence Imaging After Aerosolized Indocyanine Green Inhalation: A Novel Strategy for Treating Congenital Pulmonary Airway Malformation. J Pediatr Surg. 2025;60(1):162063.
- Bakhuis W, Kersten CM, Sadeghi AH, et al. Preoperative visualization of congenital lung abnormalities: hybridizing artificial intelligence and virtual reality. Eur J Cardio-Thorac Surg. 2023;63(1):ezad014.
- Emil S, Ferreira J, Frigon C, Guadagno E, Horge M, Laurie J. Starting on the road to pediatric enhanced recovery after surgery: strategies and themes. J Pediatr Surg Open. 2024;6:100128.
- Clermidi P, Bellon M, Skhiri A, et al. Fast track pediatric thoracic surgery: Toward day-case surgery? J Pediatr Surg. 2017;52(11):1800-1805.
- Hidayah BA, Toh ZA, Cheng LJ, et al. Enhanced recovery after surgery in children undergoing abdominal surgery: meta-analysis. BJS Open. 2023;7(1):zrac147.
|